Wie Zellprozesse sich orientieren
Robuste Proteinmuster entstehen durch zellinterne Konzentrationsgefälle.
Viele zelluläre Prozesse hängen von der richtigen Verteilung von Proteinen auf der Zellmembran ab. Verschiedene Studien haben gezeigt, dass neben Wechselwirkungen zwischen Proteinen und Transportprozessen auch die Zellform die Bildung von Proteinmustern stark beeinflussen kann. Allerdings gibt es auch Prozesse, die von der Zellform nicht beeinträchtigt werden dürfen. LMU-Physiker um Erwin Frey haben nun am Beispiel von Seestern-Eizellen aufgeklärt, wie trotz drastischer Verformungen der Zelle solche robusten Proteinmuster entstehen können: Ein Konzentrationsgefälle innerhalb der Zelle kodiert die Positions- und Forminformation der Zelle und wird durch selbstorganisierte Proteinmuster dekodiert.
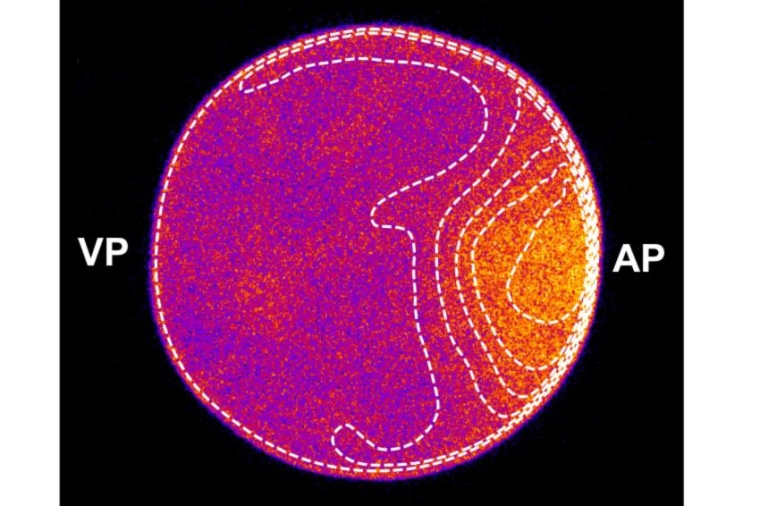
Eizellen von Seesternen sind relativ groß und transparent, deshalb eignen sie sich gut für biochemische Untersuchungen. Kurz vor der Zellteilung läuft das Enzym Rho als Impuls über die Zellmembran, was eine Oberflächenkontraktionswelle auslöst und schließlich für eine asymmetrische Teilung der Zelle sorgt. Dabei endet die Welle immer am animalen Pol der Zelle, an dem der Zellkern liegt. Um zu untersuchen, wie sich unterschiedliche Zellformen auf diesen Prozess auswirken, schlossen die Wissenschaftler Eizellen in unterschiedlich gestaltete Mikrokammern ein und zwangen sie so zu drastischen Verformungen. „Dabei zeigte sich, dass sich der Rho-Puls zwar unterschiedlich ausbreitet, aber trotzdem immer genau an seiner Zielposition am Zellkern ankommt“, sagt Frey. „Diese faszinierende Beobachtung beweist, dass der Rho-Puls die Zellform ‚kennt‘ und sich an sie anpasst.“
Zur Erklärung dieses Mechanismus haben die Wissenschaftler eine biophysikalische Theorie entwickelt, die auf der früheren Entdeckung beruht, dass der Zellzyklus-Regulator Cdk1 asymmetrisch im Zytoplasma der Eizelle verteilt ist und dort einen Konzentrationsgradienten bildet, der sich vom Zellkern ins Zytoplasma erstreckt und mit der Zeit abnimmt. Dieser Gradient ermöglicht es den Proteinen auf der Membran, sich an die Zellform anzupassen. „Die entscheidende Erkenntnis ist, dass das Protein, das Rho aktiviert, den Gradienten in der Nähe der Membran misst und eine Schwellenkonzentration markiert: Es bildet ein frontartiges Konzentrationsprofil auf der Membran, so dass die Front genau bei der Schwellenkonzentration liegt. An dieser Frontposition wiederum löst der Rho-Aktivator lokal einen Aktivitätspuls von Rho aus“, sagt Manon Wigbers, die Erstautorin des Artikels. Während der Gradient abklingt, bewegt sich die Position dieses Schwellenwerts je nach Zellform mit unterschiedlicher Geschwindigkeit entlang der Membran. Über diese Proteinkonzentrationsprofile wird die im Gradienten kodierte Forminformation in eine mechanisch-chemische Antwort umgewandelt – die Kontraktionswelle, die über die Membran läuft.
„Unsere Ergebnisse illustrieren die Bedeutung der selbstorganisierten Bildung von hierarchischen Mustern für das Verständnis biologischer Funktionen“, sagt Frey. Dabei ist es den Wissenschaftlern gelungen, zwei Hauptparadigmen auf dem Gebiet der Proteinmusterbildung zu integrieren: die Selbstorganisation aufgrund von Reaktion und Diffusion sowie die Nutzung von Positionsinformationen. „Wir gehen davon aus, dass ein solcher Mechanismus zur Formanpassung, der auf einer Hierarchie von Proteinmustern basiert, ein allgemeines physikalisches Prinzip für die Erkennung und Steuerung der Zellform darstellen könnte“, sagt Frey.
LMU / DE